Partie 4 : Vers une métrologie du vieillissement à partir des télomères.

Mesure du vieillissement: Les télomères des témoins de l’âge physiologique
La mesure de la longueur des télomères est un outil très précis pour déterminer l’âge physiologique de nos cellules et de nos organes.
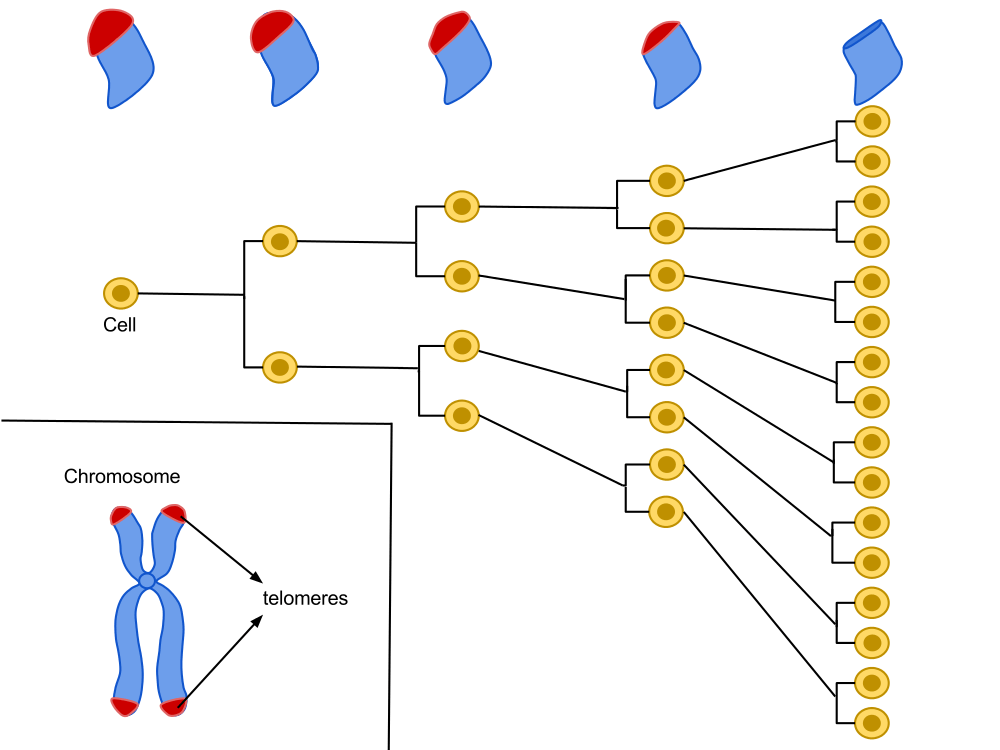
Situées aux extrémités de nos chromosomes, les télomères sont des séquences très répétitives comportant la suite de nucléotides TTAGGG. Une cellule est programmée pour se diviser un certain nombre de fois et, à chaque division cellulaire, ces extrémités chromosomiques se raccourcissent un peu plus, jusqu’à atteindre une taille critique. La cellule va alors stopper sa croissance pour entrer en sénescence.
Le mode de vie, les habitudes alimentaires le stress, les facteurs environnementaux ainsi que l’âge peuvent accélérer le raccourcissement des télomères. La mesure de leur longueur peut donc fournir des indications précieuses sur l’avancement de l’âge réel de nos cellules, ainsi que sur les facteurs l’influençant. Pour toutes ces raisons, la mesure des télomères est un remarquable moyen métrologique du degré de vieillissement d’un organisme, et elle peut inciter les individus à prendre des mesures afin de préserver leur santé.
Les travaux de Hayflick ont montré qu’il existe un capital de divisions pour plusieurs lignées cellulaires. Il est proportionnel à la longévité de l’espèce et connaît des écarts entre les individus d’une même espèce. A chaque cycle de division cellulaire, l’extrémité des chromosomes (télomère) perd un fragment d’ADN. Après plusieurs divisions, la fonction du télomère, qui contribue à maintenir la stabilité de l’ADN, est altérée, ce qui pourrait être le substratum de «l’horloge biologique».
L’échantillon à tester : la mesure de la longueur des télomères peut être faite sur des échantillons cellulaires ou tissulaires, cependant on privilégiera d’effectuer cette mesure sur les télomères des leucocytes, un type de cellules présentes dans le sang, permettant un prélèvement peu invasif.
Cinq grandes méthodes de mesure des télomères pour la métrologie du vieillissement
Southern blots of Terminal Restriction Fragments (TRFs)
Développée en 1990, il s’agit de la technique la plus archaïque, mais aussi de la plus largement utilisée. Cette technique estime le nombre moyen de répétitions terminales TTAGGG portées par l’ensemble des chromosomes. Elle repose sur la technique d’hybridation in situ qui identifie les répétitions TTAGGG coiffant les télomères. L’ADN télomérique est digéré par des enzymes de restriction, il en résulte plusieurs petits fragments d’ADN de tailles différentes. Afin de connaître la taille de chaque fragment d’ADN télomérique, on utilise le Southern Blot.
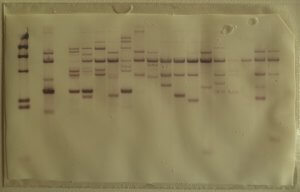
Pour ce faire, les fragments télomériques obtenus après digestion sont séparés par électrophorèse sur gel puis transférés sur une membrane de nitrocellulose ou de nylon, supports solides qui facilitent la dénaturation de l’ADN (passage de la forme double-brin à simple-brin) et son hybridation avec une sonde. Cette étape est cruciale afin de permettre l’hybridation d’une sonde radioactive (fragment d’ADN complémentaire de la séquence recherchée). La position des fragments de restriction est alors révélée par radiographie et leur taille est estimée par comparaison entre la distance qu’ils ont parcourue dans le gel et celle couverte par des fragments de longueur connue [1][2].
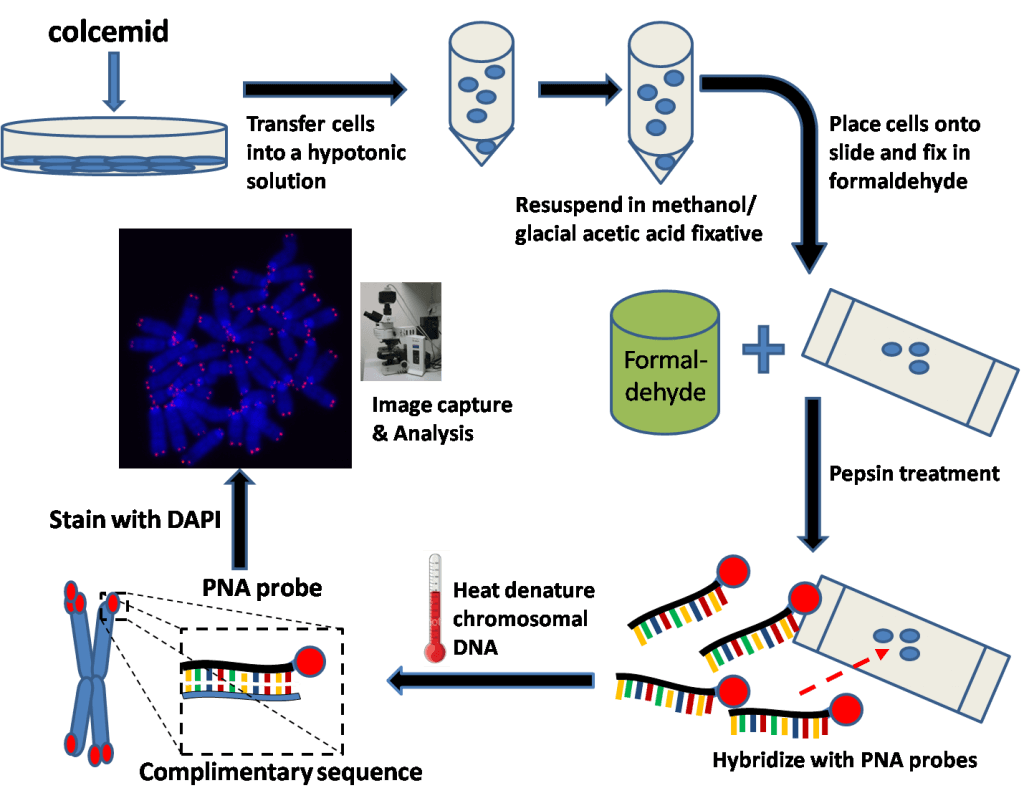
Q-Fish
Il s’agit aussi d’une hybridation in situ, mais contrairement au Southern Blot, la sonde n’est pas radioactive, mais fluorescente. L’inconvénient de cette méthode, c’est qu’elle requiert une importante quantité́ d’ADN pouvant aller jusqu’à 20 μg, alors que quelques ng suffisent pour d’autres techniques comme la PCR-Q [3][4].
Flow-FISH
La technique de Flow-FISH est similaire au Q-FISH à l’exception du fait qu’elle permet une analyse directe des télomères sans extraction de l’ADN au préalable. Par la suite, les cellules marquées sont triées dans un cytomètre en flux. Cette méthode est fort coûteuse et peu utilisée, car elle nécessite d’importants équipements. Néanmoins, elle reste très intéressante: elle permet de réduire les étapes de purification et permet l’analyse simultanée de la longueur de télomère dans différents type cellulaire [7][8].
TAT pour la mesure de la longueur des télomères
TAT® évalue la longueur des télomères individuellement. La technologie TAT® est basée sur l’hybridation fluorescente in situ à haut débit, permise par une approche High Content Screening (HCS). TAT® fournit une mesure complète de la longueur des télomères par l’intermédiaire d’un histogramme. Il donne des indications sur les télomères des plus courts aux plus longs, donne la fréquence par classe de longueur, la moyenne ainsi que les valeurs médianes [9].
PCR-Q
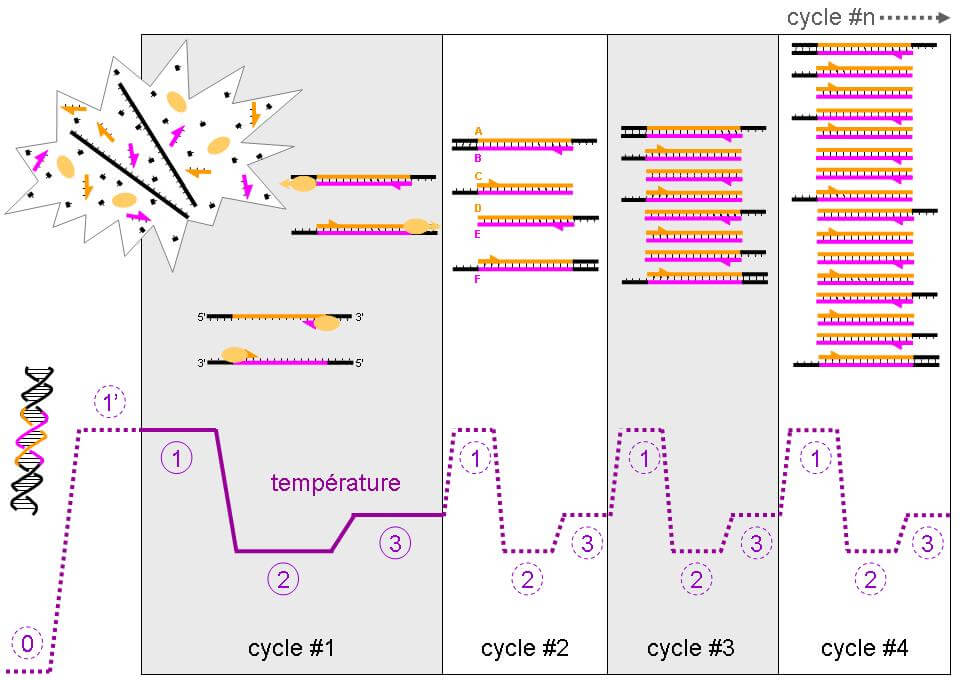
Mise au point en 2003, la PCR-Q est une technique plus rapide et plus aisée. Cette technique est basée sur le principe de l’hybridation. Une séquence d’ADN est extraite puis placée dans une machine qui va permettre d’effectuer trois étapes différentes (répétées une quarantaine de fois): une dénaturation (passage de l’ADN double brin à simple brin), une hybridation avec la sonde puis une amplification du produit hybridé. La sonde est un fragment d’ADN complémentaire de la séquence d’intérêt et va permettre d’amplifier, c’est à dire d’augmenter le nombre de copies, de ce gène. Plus une séquence d’ADN est amplifiée rapidement, plus il est présent dans un échantillon donné.
Grâce à plusieurs paramètres, notamment le ratio du nombre de copies du motif télomérique (T) par rapport à un gène contrôle (S) (T/S), on peut déterminer le nombre de répétitions TTAGGG, caractéristiques de l’ADN télomérique [2][5][6].
STELA (Single TElomere Length Analysis)
Cette technique diffère de la PCR-Q par le fait qu’elle permet d’amplifier, non pas un fragment de télomère mais la totalité de sa séquence. Son principe est le même pour le reste de la procédure. Elle est en revanche plus longue car elle nécessite une analyse chromosome par chromosome et non pas sur de l’ADN total [2][7][8].
La mesure de la longueur des télomères et métrologie du vieillissement
Les techniques de PCR semblent être les meilleures en terme de reproductibilité, mais à l’instar des méthodes basées sur l’hybridation in situ, elles ne peuvent amplifier des télomères de plus de 25 kb. Il est possible d’observer des télomères de plus de 50 kb, mais on préfèrera dans ce cas le Southern Blot.
On sait que tous les organes du corps ne vieillissent pas de la même façon, et même si les leucocytes sont un type cellulaire représentatif pour l’étude du vieillissement, les tests ci-contre analysent essentiellement des populations cellulaires provenant d’un échantillon sanguin, et cela reste encore trop réducteur. L’analyse de la longueur télomérique faite à partir d’un prélèvement tissulaire (biopsie) est possible, mais requiert un encadrement médical et une intervention très invasive.
Où peut-on demander une analyse de nos télomères ?
Chez Medfuture, disposons d'une technologie de pointe et propriétaire qui mesure plus que 100 000 télomères individuels. Plus de renseignements
SOURCES:
Katidja Allaoui sur http://www.longlonglife.org/
Sources :
[1] Chatterjee, S. (2017). Telomeres in health and disease. Journal of oral and maxillofacial pathology: JOMFP, 21(1), 87.
[2] Blasco, M. A. (2007). Telomere length, stem cells and aging. Nature chemical biology, 3(10), 640-649.
[3] Leri, A., Franco, S., Zacheo, A., Barlucchi, L., Chimenti, S., Limana, F., … & Blasco, M. A. (2003). Ablation of telomerase and telomere loss leads to cardiac dilatation and heart failure associated with p53 upregulation. The EMBO journal, 22(1), 131-139.
[4] Cawthon, R. M., Smith, K. R., O’Brien, E., Sivatchenko, A., & Kerber, R. A. (2003). Association between telomere length in blood and mortality in people aged 60 years or older. The Lancet, 361(9355), 393-395.
[5] Canela, A., Vera, E., Klatt, P. & Blasco, M.A. High-thoughput telomere length quantification by FISH and its application to human population studies. Proc. Natl. Acad. Sci. USA 104, 5300–5305 (2007).
[6] Teyssier, J. R., Ragot, S., Donzel, A., & Chauvet-Gelinier, J. C. (2010). Longueur des télomères dans le cortex des patients atteints de troubles dépressifs. L’Encéphale, 36(6), 491-494.


